Các tư tưởng về độ tan, bảng tính tan là những gì được học tập trong chương trình hóa học lớp 8 với lớp 11. Cùng chúng tôi khám phá nội dung chi tiết của các khái niệm này ngay trong bài viết dưới đây.
Bạn đang xem: Bảng tính tan hóa học
Các có mang về độ tan
Độ tan là gì?
Độ tan tốt độ hài hòa là tên thường gọi chung nhằm chỉ điểm sáng hòa tan của hóa học rắn, lỏng hoặc chất khí vào dung môi để tạo ra một dung dịch đồng nhất. Độ phối hợp của một chất dựa vào chính vào các đặc điểm vật lý và tính chất hóa học của chất tan, dung môi, nhiệt độ, áp suất và p
H của dung dịch.
Chất chảy và hóa học không tan
Ở vào nước có chất chảy và chất ko tan, chất tan ít, chất chảy nhiều. Lấy một ví dụ trong 100g nước hòa tan:
> 10 gam chất tan được call là hóa học dễ chảy hay hóa học tan nhiều.Độ hòa tan của một số các axit, bazơ, muối
Độ tung của Axit: Hầu hết axit chảy được trong nước, trừ axit silixicO3, H4Si
O4,…Độ tan của Bazo: phần lớn các bazo không tan vào nước, trừ một số như: KOH, Na
OH,..Độ tan của Muối:
Muối của natri (Na+), kali (K+) đều tan.
Muối nitrat (-NO3) đều tan
Phần lớn các muối clorua (-Cl), sunfat (=SO4) rất nhiều tan được. Nhưng lại phần lớn các muối cacbonat (=CO3) không tan.
Ví dụ: mang đến hai hỗn hợp muối Ca
CO3 với Na
Cl vào cốc nước, thì ta thấy Na
Cl tan còn Ca
CO3 ko tan vào nước.
10+ yếu tố ảnh hưởng đến độ phối hợp của một vài chất
Nhiệt độ
Độ rã của hóa học khí sẽ tỷ lệ nghịch với nhiệt độ của dung môi. Tín đồ ta thường đun nóng chất khí để đào thải một số hóa học như CO2 xuất xắc O2 ra khỏi dung môi mà lại không làm biến đổi hay phân bỏ chất. ở bên cạnh đó, còn làm hợp chất đó được ổn định.
Đối với chất rắn:
Chất rắn thu nhiệt lúc nhiệt độ càng cao → độ hài hòa càng lớn.Chất rắn tỏa nhiệt độ khi nhiệt độ giảm → độ hòa tan càng tăng.Áp suất (đối với hóa học khí)
Theo định nguyên tắc Henry, nếu các chất khí gồm độ tan bé dại và áp suất không thực sự lớn thì lúc tăng áp suất trên bề mặt chất lỏng thì lượng khí hòa tan trong một thể tích chất lỏng xác định cũng biến thành tăng, với ngược lại.
Độ phân cực của các chất tan cùng dung môi
Các hóa học phân cực thường rất dễ tan rộng trong môi trường xung quanh dung môi phân cực, ví dụ như kiềm, nước, hỗn hợp muối, axit vô cơ,…
Những chất ít phân cực cũng biến thành dễ chảy trong môi trường dung môi hữu cơ yếu phân rất như chloroform, toluene, benzene, dicloromethan,…
Dạng thù hình
Trong 1 dung môi, những nhiều loại chất rắn vô định hình sẽ sở hữu được độ tan to hơn những hóa học rắn dạng tinh thể. Do khi chất rắn cơ mà ở dạng kết tinh thì nó đã có cấu trúc mạng lưới tinh thể tương đối bền vững. Và bởi vậy mà lại nó bắt buộc nhiều tích điện để nhằm phá vỡ cấu tạo hơn.
Ngược lại, chất rắn vô đánh giá sẽ tạm thời bằng dạng tinh thể, cũng chính vì vậy mà bọn chúng thường có xu hướng chuyển quý phái dạng tinh thể.
Hiện tượng hydrat hóa
Chất rắn hay tồn tại dưới dạng ngậm nước hoặc dạng khan trong quy trình kết tinh. Tính tung của hóa học rắn khi ở dạng khan sẽ to hơn dạng ngậm nước.
Hiện tượng nhiều hình
Với môi trường kết tinh khác biệt sẽ tạo điều kiện để hóa học rắn vĩnh cửu dưới những tinh thể khác nhau. Hầu như chất này cũng có thể có tính chất vật lý và độ tan không giống nhau như Hydrat, đồng kết tinh,… Thông thường, hầu như tinh thể kém bền bỉ sẽ tốn ít năng lượng để phá tan vỡ cấu trúc, thế nên mà chúng cũng dễ tan hơn.
Độ p
H của dung dịch
Khi kiềm hóa dung môi, độ tung của axit yếu hèn sẽ tăng lên nhiều hơn.Nếu axit hóa dung môi, độ tan của các chất kiềm yếu sẽ tăng nhiều lên.Đối với số đông chất lưỡng tính (vừa tất cả tính axit, vừa gồm tính bazơ), độ tan của những chất giảm dần khi nhưng mà độ pH càng ngay gần điểm đẳng điện cùng ngược lại.
Chất năng lượng điện ly
Độ tan của những chất tan có thể bị giảm vì chưng chất điện li, vì vậy mà bạn cần pha loãng hóa học điện li khi trộn lẫn dung dịch.
Các ion cùng tên
Trong trường hợp nồng độ của những ion thuộc tên tăng lên, đang làm cân bằng điện li của chất tan thì sẽ làm chuyển dịch về hướng phân tử không nhiều tan với làm giảm đi độ tan của chất.Vì vậy, trong quy trình hòa tan, cần triển khai với phần nhiều chất không nhiều tan trước, rồi mới tới những chất dễ tan.
Hỗn đúng theo dung môi
Nếu như bạn kết hợp các các thành phần hỗn hợp dung môi đồng tan cùng với nước ví dụ như glycerin-ethanol-nước thì vẫn làm tăng cường độ tan của các chất cạnh tranh tan.
Bảng tính tan
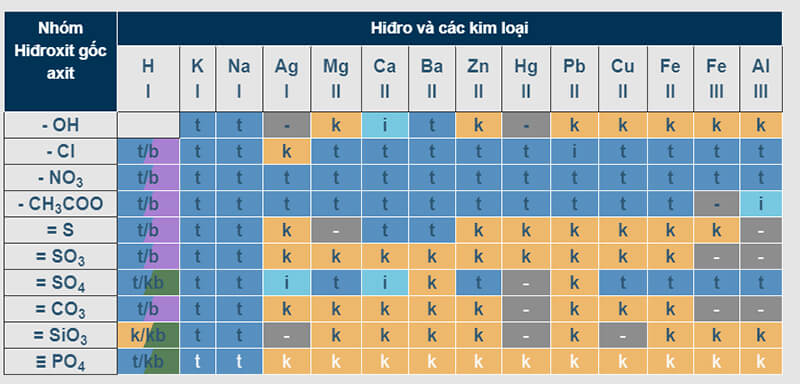
Cách hiểu bảng tính tan
Bảng tính chảy là gì? Bảng tính chảy là tập hợp bao gồm các sản phẩm và những cột. Cột là những cation kim loại, còn hàng bao hàm các anion gốc axit (hay OH-). Với một chất thay thể, ta sẽ xác định ion dương, ion âm. Khi giống như theo những hàng và các cột tương ứng, sẽ biết được trạng thái của chất đó trên một ô sẽ như thế nào.
Ý nghĩa của bảng tính tan
Bảng tính tan cho biết tính tan của các chất trong nước:
Chất tung được trong nướcChất không tan trong nước
Chất ít tan trong nước
Chất dễ phân hủy, bay hơi …
Từ kia ta hoàn toàn có thể làm các bài nhận thấy các hỗn hợp mất nhãn hay các bài toán có kỹ năng và kiến thức liên quan.
Ví dụ: nhận thấy dung dịch muối fe (III) bằng dung dịch Na
OH tạo thành thành kết tủa gray clolor đỏ Fe(OH)3.
Ta có phương trình hóa học: Fe
Cl3 + 3Na
OH → 3Na
Cl + Fe(OH)3 ↓ (chất kết tủa gray clolor đỏ)
Cách minh bạch những bazơ ko tan thường gặp mặt qua màu sắc sắc
| Bazơ | Màu sắc |
| Mg(OH)2, Zn(OH)2, Pb(OH)2 | Trắng |
| Al(OH)3 | Keo trắng |
| Fe(OH)2 | Trắng xanh |
| Fe(OH)3 | Nâu đỏ |
| Cu(OH)2 | Xanh lam |
| Cr(OH)2 | Lục xám |
| Mn(OH)2 | Hồng nhạt |
Cách ghi lưu giữ bảng tính tan của các chất

Qua bảng tổng đúng theo tính tan
| Hợp chất | Độ tan | Ngoại trừ |
| Axit (cột ion H+ với anion nơi bắt đầu axit tương ứng) | Đều tan | H2Si O3 |
| Bazơ (hàng ion -OH và những cation tương ứng) | Không tan | Li OH, Na OH, KOH, NH4OH, Ca(OH)2, Ba(OH)2. |
| Muối Liti (Li+), muối hạt Natri (Na+), muối Kali (K+), muối hạt amoni (NH4+) | Đều tan | |
| Muối bạc Ag+ | Không tung (thường chạm mặt Ag Cl) | Ag NO3, CH3COOAg. Xem thêm: Đậu Hạt To Màu Đỏ - Lựa Chọn Nào Tốt Hơn Cho Sức Khỏe |
| Muối Nitrat (-NO3) cùng muối Axetat (-CH3COO) | Đều tan | |
| Muối Clorua (-Cl), muối hạt Bromua (-Br) với muối Iotua (-I) | Đều tan | Ag Cl: kết tủa trắng Ag Ag Pb |
| Muối sunfat =SO4 | Đều tan | Ba SO4, Ca SO4, Pb SO4: trắng Ag2SO4: ít tan |
| Muối sunfit =SO3, muối cacbonat =CO3 | Không tan | Trừ muối bột với sắt kẽm kim loại kiềm (K+, Na+…) với NH4+ |
| Muối Sunfua -S2 | Không tan | Ngoại trừ muối với sắt kẽm kim loại kiềm, kiềm thổ với NH4+ |
| Muối photphat ☰PO4 | Không tan | Trừ muối hạt với Na+, K+ cùng NH4+ |
Thường xuyên thực hành
Một trong những cách học bảng tính tung lớp 11 nhanh nhất có thể là thường xuyên thực hành. Thay bởi chỉ ghi nhớ kỹ năng và kiến thức trong sách vở, hãy liên tục thực hành, làm bài xích tập và ghi nhớ những phản ứng hóa học của các chất. Bài toán ghi lưu giữ hình ảnh diễn ra trong thực tế sẽ in sâu trong trái tim trí của chúng ta hơn là vấn đề chỉ nhìn bé chữ trên giấy.Bên cạnh đó, việc tiếp tục làm các bài tập về tính chất tan cũng chính là một cách để ghi nhớ tốt hơn về độ tan của những chất hay được sử dụng nhờ bài toán lặp đi lặp lại thường xuyên.
Ghi nhớ những quy tắc rút gọn về tính tan
Quy tắc rút gọn bảng tính rã của muốiCác muối gồm gốc halogen đều có công dụng tan trong nước như -Br, -Cl, -F,…
Dung dịch muối tất cả gốc Sunfit (SO3), Silicat (Si
O3), Cacbonat (CO3), Sunfua (S) đông đảo khó tan, hoặc không tan (tạo thành hóa học kết tủa) vào nước. Mặc dù nhiên, nếu bọn chúng kết phù hợp với kim loại gồm tính kiềm (Na, K, Ca…) thì sẽ khởi tạo ra rất nhiều hợp chất muối rã được vào nước.
Bên cạnh đó, một vài kim nhiều loại tính kiềm (Na, K,..) khi kết hợp với muối đang tan được vào nước. Các bạn có thể nhận thấy điều này dễ dãi khi quan sát vào bảng tính chảy (có kí hiệu chữ T, có nghĩa là chất dễ dàng tan)
Đa số những hợp chất muối có gốc Sunfat (SO4) hầu như tan vào nước, trừ muối bột Sunfat của kim loại Bari là ko tan (tạo thành kết tủa trắng).
Một lưu ý quan trọng là trong bảng tính rã của một số trong những chất vào nước, một trong những ít một số loại muối không tồn trên hoặc dễ bị phân diệt ngay trong nước. Phần đông chất này được kí hiệu bởi dấu “-”. Hãy ghi nhớ chúng để tránh không đúng sót lúc làm bài bác tập nhé.
Quy tắc rút gọn đối với axit và bazơĐa số những loại axit đầy đủ tan dễ dãi trong nước, tuy nhiên:
H2CO3 dễ dẫn đến phân diệt trong nướcCác axit gồm gốc silicic thì không tan, ví dụ như H2Si
O3, H4Si
O4,…
Đa số những bazơ đa số không rã trong nước, ngoại trừ:
Bazơ của những kim loại kiềm như Li, K, N đa số tan trong nướcBazơ của những kim loại nhóm 2 vẫn ít tung trong nước
Hy vọng, nội dung bài viết về bảng tính tan với độ rã trên đây đã là hành trang hữu ích, giúp các bạn đạt được điểm cao trong số kỳ thi sắp đến đến. Ghi lưu giữ bảng tính rã của muối, axit, bazơ và những chất khác nhằm tích lũy thêm những kiến thức cùng vận dụng chúng vào đời sinh sống thực tế.
bạn đã biết bí quyết học ở trong bảng tính rã Hóa học nhanh nhất có thể hay chưa? thuộc theo dõi ngay bài viết này nhằm học mẹo ghi nhớ hiệu quả.
Trong bộ môn Hóa học, họ cần yêu cầu ghi nhớ một số trong những bảng đặc biệt như bảng tuần trả nguyên tử khối và hóa trị, bảng tính tan. Câu hỏi ghi lưu giữ những kỹ năng trong bảng này là một trong những lợi thay để học tốt môn Hóa học. Vậy mẹo nhằm ghi nhớbảng tính rã Hóa học sớm nhất như thế nào cùng Giấy Hải Tiến tìm hiểu thêm ngay sau đây.
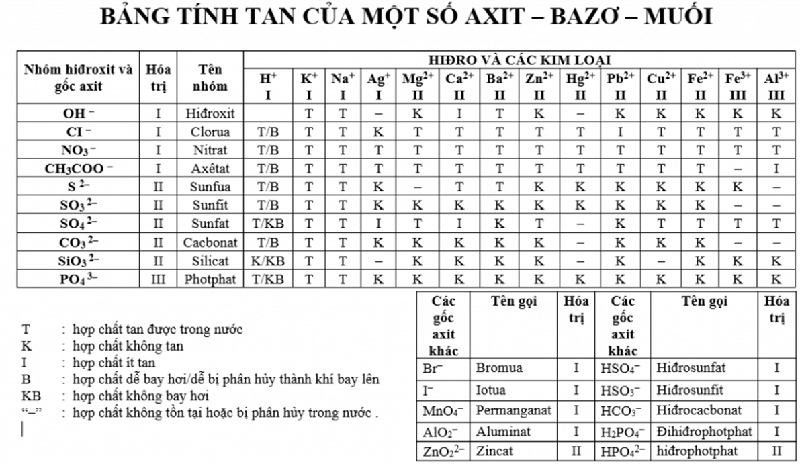
Bảng tính tan chất hóa học có ý nghĩa sâu sắc gì?
Bảng tính tan là 1 bảng thực hiện trong Hóa học, nó thể hiện rõ kỹ năng tan chảy hoặc ko tan tan của một số trong những hóa hóa học nhất định trong môi trường xung quanh nước. Những chất như: axit, bazơ, muối,... ở nhiệt độ trung bình là 25,25 độ C bao gồm tan vào nước hay không là phụ thuộc vào bảng tính rã này.

Bảng tính chảy hóa học
Trong bảng tính tan, những kí hiệu được chuyên viên quy định ý nghĩa như sau:
T: Hợp hóa học dễ tan.
I: Hợp hóa học ít tan.
K: Hợp hóa học không tan.
“-“: Hợp hóa học bị phân hủy do nước hoặc không tồn tại trong môi trường xung quanh nước.
Khả năng hòa tan của những chất axit, bazơ cùng muối gồm những điểm sáng chung như sau:
Đối cùng với Axit: các hợp hóa học axit đầy đủ dễ tung trong môi trường xung quanh dung môi, nước ngoài trừ một trong những chất thuộc nhóm Axit Silic như H2Si
O3, H2Si
O4,...
Đối với Bazơ: những hợp hóa học bazơ đầy đủ không rã trong môi trường dung môi, trừ một số trong những kim loại quan trọng như bazơ kiềm gồm: Li, K, N là chúng có chức năng tan trong nước.
Đối cùng với Muối: phần lớn các hợp hóa học muối đang tan vào nước, một số nhóm muối hạt như: muối gồm gốc halogen (Cl, Br, F), muối nitrat, muối clorua, sunfat. ở bên cạnh đó, vẫn còn một số hợp chất hiếm ko tan như: muối bột cacbonat, muối cội Silicat, Sunfit.
Bảng tính tung hóa học quan trọng đặc biệt như nắm nào?
Bảng tính tan là 1 trong công rứa học tập rất quan trọng đặc biệt trong môn hóa học. Nó cần thiết để xử lý các bài bác tập về độ tan, độ kết tủa, độ cất cánh hơi. Một số trong những bài học yêu cầu học viên phải ghi nhớ bảng tính tan thì mới có thể giải đáp được. Kế bên ra, câu hỏi ghi ghi nhớ bảng tính tan giúp học viên đi thi sẽ có tác dụng bài thuận lợi và đúng mực hơn cực kỳ nhiều.

Bảng tính rã hóa học là một kiến thức hết sức quan trọng
Vì thế, bắt buộc học trực thuộc bảng tính tan tức thì từ số đông năm đầu tiên học Hóa học nhằm tích lũy được kiến thức và kỹ năng thành kinh nghiệm tay nghề và tiết kiệm ngân sách và chi phí được thời hạn khi giải các bài tập hóa trong học tập, thi cử và đồng thời cải thiện được con kiến thức nhanh nhất có thể trong bộ môn Hóa học.
Các mẹo học thuộc nhanh bảng tính chảy hóa học cấp tốc nhất
Việc học thuộc bảng tính tan quan trọng như vậy thì liệu có phương pháp nào nhằm học thuộc và ghi lưu giữ một cách nhanh nhất có thể hay không? thuộc Giấy Hải Tiến xem thêm các tuyệt kỹ học trực thuộc bảng tính rã Hóa học công dụng ngay sau đây:
Học đến đâu thực hành thực tế đến đó
Như ông phụ thân ta vẫn nói từ thời gian xưa, câu hỏi học sẽ song song với hành, do thế cách để ghi nhớ nhanh nhất chính là vừa học với vừa thực hành. Học sinh hoàn toàn có thể thực hành dưới nhiều hiệ tượng khác nhau như có tác dụng nhiều bài bác tập về nhà, thực hành thực tế thí nghiệm thực tế. Khi bạn làm càng nhiều bài bác tập đã ghi lưu giữ về khả năng tan của những chất và cả nguyên tử khối của chúng.
Cách ghi nhớ này rất công dụng vì nó là một bề ngoài học trực thuộc tự nhiên, không nỗ lực để ghi nhớ. Khi có tác dụng nhiều bài bác tập, những kiến thức vẫn trở thành rất gần gũi và từ bỏ đó học sinh sẽ thế vững các nội dung để vận dụng dễ dãi vào bài xích học, bài xích thi.

Thực hành là phương thiết bị ghi nhớ xuất sắc nhất
Tương từ đó, vấn đề thực hành cũng giống như vậy, học viên sẽ được từ bỏ tay làm thí nghiệm sẽ ghi nhớ lâu hơn, từ bây giờ bạn tận mắt chứng kiến các phản ứng hóa học diễn ra, quan cạnh bên được những hợp hóa học có đặc điểm ra sao cùng cần điều kiện gì để chất đó hòa tan. Do thế lúc này học sinh đã ghi nhớ cấp tốc hơn bằng phương pháp liên tưởng đến những thí nghiệm đó
Ghi nhớ nhanh bảng tính tan chất hóa học qua thơ ca
Nếu bàn sinh hoạt thuộc bảng tính tan Hóa học theo các cách thức truyền thống thì sở hữu lại kết quả không hề cao và thuận tiện chán nản. Do do, lượng kiến thức cần ghi nhớ vô số và cấp thiết nhớ luôn bền dài. Vì vậy, những thầy cô luôn luôn tìm tòi học hỏi và giao lưu những phương thức mới nhằm học thuộc thuận tiện hơn.
Do đó, một số trong những bài thơ ca đã ra đời để nói về đặc trưng tính tan của những chất hóa học. Đây là cách thức học thuộc nhanh lẹ và còn thú vị, khiến cho bài học trở nên tấp nập hơn. Một vài bài thơ ca nhằm ghi nhớ bảng tính tung như:

Bài thơ ghi ghi nhớ bảng tính tung hóa học
Tại bài viết trên đây, Giấy Hải Tiến đã share đến chúng ta học sinh kiến thức về bảng tính tung Hóa học và các mẹo ghi nhớ ngôn từ trong bảng làm thế nào để cho hiệu quả. Hi vọng với đông đảo kiến thức bổ ích này đang giúp chúng ta học sinh kiếm tìm thêm được các cách thức ghi nhớ nhanh nhất để áp dụng giải đáp những bài tập hóa học thật dễ dàng.














